恒瑞19K正式上市 是国内首个帮助降低化疗后感染的长效制剂

恒瑞19K正式上市 是国内首个帮助降低化疗后感染的长效制剂
恒瑞医药近日宣布,其自主研发的用于治疗和预防肿瘤化疗后非髓性中性粒细胞减少症的生物创新药硫培非格司亭(商品名:艾多®,简称19K,)正式上市。据了解,硫培非格司亭是国内首个与进口短效G-CSF对比获得优效结果的长效G-CSF制剂,其创新结构获得了WHO全新国际通用名,也获得了国际多项专利。临床上常用粒细胞刺激因子(G-CSF,包括短效rhG-CSF和长效PEG-rhG-CSF)以预防和治疗肿瘤患者化疗后的中性粒细胞过度降低,减少化疗后骨髓功能抑制所致感染的发生率,保证化疗顺利进行。
目前在国内的长效G-CSF市场上,除了恒瑞此次上市的艾多以外,还有石药集团百克生物制药的津优力®和齐鲁制药的新瑞白®这两款药物。恒瑞医药表示,考虑到临床数据,恒瑞艾多®临床优效的疗效和安全性,竞争优势明显。因此,艾多®上市后,有望成为恒瑞又一个支柱性产品。
百济神州治疗华氏巨球蛋白血症新药获FDA快速通道资格
百济神州7月23日宣布已获得美国食品药品监督管理局(FDA)授予其在研BTK抑制剂zanubrutinib快速通道资格用于治疗华氏巨球蛋白血症(WM)患者。百济神州计划于2019年上半年提交新药上市申请(NDA)。
Zanubrutinib(BGB-3111)是一种在研的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂,目前正在全球及中国进行广泛的关键性临床试验项目,作为单药和与其他疗法进行联合用药治疗多种淋巴瘤。
百济神州今天宣布这项全球临床3期试验已完成患者入组。另外,zanubrutinib还在进行一项用于治疗慢性淋巴细胞白血病(CLL)一线患者的全球临床3期试验和一项与GAZYVA® (奥比妥珠)联合治疗复发或难治性滤泡性淋巴瘤的关键性2期临床试验。在中国,百济神州已完成了zanubrutinib的3项关键性临床2期试验的患者入组,分别用于治疗套细胞淋巴瘤(MCL)、CLL和WM,预期将于今年第三季度递交在中国针对MCL的新药上市申请。
复星医药重组抗PD-L1全人单克隆抗体注射液获批临床
复星医药近日公告称,公司控股子公司复宏汉霖及汉霖制药收到国家药监局批准,同意“重组抗PD-L1全人单克隆抗体注射液”用于实体瘤治疗临床试验,两公司拟于近期条件具备后开展该新药临床I期试验。据了解,该新药为复星药业自主研发的创新型治疗用生物制品,截至今年6月已投入研发费用约4400万元。
目前,在国内市场上,尚未有已上市的重组抗PD-L1 全人单克隆抗体注射液,在全球范围内上市的则有罗氏的Tecentriq(Atezolizumab)、默克和辉瑞联合开发的Bavencio(Avelumab)、阿斯利康的Imfinzi(Durvalumab)。IQVIA MIDASTM最新数据显示,2017 年度,重组抗PD-L1 全人单克隆抗体注射液的全球销售额约为5.0 亿美元。
西安杨森亿珂获批用于CLL/SLL等癌症一线治疗
7月20日,强生制药子公司西安杨森制药有限公司宣布,旗下亿珂®(伊布替尼胶囊)扩展适应症获批,用于慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的一线治疗。
亿珂®(伊布替尼胶囊)是每日口服一次的布鲁顿酪氨酸激酶(BTK)抑制剂,具有高达91%的有效率,对比苯丁酸氮芥,显著降低患者的疾病进展和死亡风险,并具有良好的耐受性,已被多个国际和国内治疗指南推荐用于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的一线治疗。
中枢神经药物思瑞康缓释片在华获批新适应症
7月19日,绿叶制药集团宣布其中枢神经药物思瑞康缓释片(富马酸喹硫平缓释片)的新适应症——双相情感障碍的抑郁发作,已于近日正式获得中国药品监督管理局的批准。
公开资料显示,思瑞康缓释片是具有抗抑郁特性的非典型抗精神病(AAP)药物,主要用于治疗精神分裂症和双相情感障碍,在部分地区还获准用于治疗抑郁症和广泛性焦虑症。今年上半年,绿叶制药向阿斯利康收购了思瑞康(富马酸喹硫平片)及思瑞康缓释片在中国等51个国家和地区的业务,目前收购事项已完成。而此次获批的“双相情感障碍的抑郁发作”适应症,是思瑞康缓释片在中国获批精神分裂症以外的另一个适应症。
- 礼进生物将在2023 ASCO上报告4-
礼进生物将在2023年美国临床肿瘤学会 (ASCO) 年会上...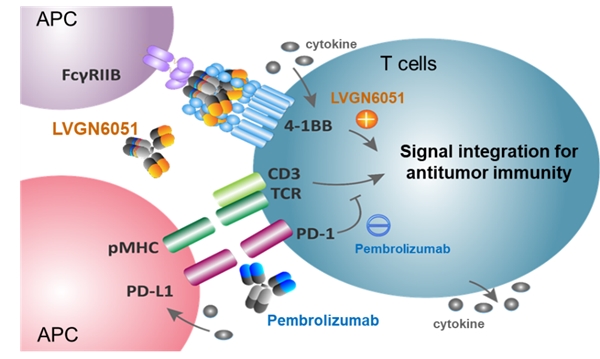
- 脑静脉血栓实现智能化诊断,脑卒中AI研究
近日,推想医疗与首都医科大学附属北京朝阳医院放射科杨旗教授团...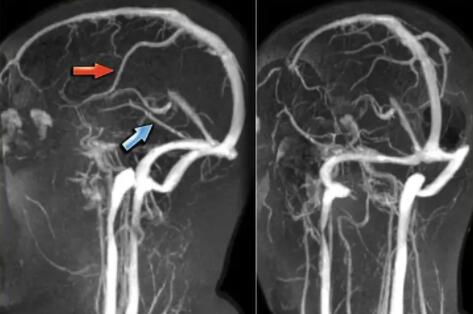
- 科兴制药产业布局再发力 探索合成生物技术
11月2日,科兴制药(股票代码:688136)发布公告,公司...
- 拜耳转移乳腺癌ErSO疗法尚未进入临床试
此前有报道称拜耳一种小分子药物ErSO对动物体内的癌细胞有9...