再生疗法获FDA优先审评资格 有望年底获批
今日,致力于为罕见病患者开发创新性疗法的生物医药公司Enzyvant Sciences宣布,FDA接受了其在研疗法RVT-802的生物制剂许可申请(BLA),同时还授予它优先审评资格。RVT-802是一种新型的基于组织的再生疗法,旨在治疗小儿先天性无胸腺症。预计这一申请将在2019年12月得到批复。

在美国,每年约有20名先天性无胸腺症患儿出生。因为出生时即没有胸腺,从而无法产生抵御感染以及调节免疫系统所必需的正常功能的T细胞,进而导致严重的免疫缺陷。先天性无胸腺症与完全DiGeorge异常(cDGA),CHARGE综合症和FOXN1缺乏相关。由于易发生感染,患儿通常于2岁前死亡。目前,FDA尚无针对该病的获批疗法。
RVT-802设计为一次性治疗免疫缺陷的再生疗法,旨在于无胸腺情况下,复制在健康和功能正常的免疫系统中发生的“T细胞起始于骨髓干细胞,再转到胸腺中发育完全”的这一过程。来自婴儿胸腺组织的RVT-802经处理和培养后,被植入患儿的四头肌。患儿骨髓干细胞迁移至植入的组织产品处,被训练成具有免疫活性的新生T细胞。随着T细胞生成能力的恢复,可以进一步恢复免疫系统的功能,以及恢复身体对抗感染的能力。
RVT-802疗法是基于杜克大学(Duke University)的Mary Louise Markert教授的研究成果。这些研究结果被发表在《新英格兰医学杂志》,以及许多其它同行审评的科学期刊和临床出版物上。2016年,Enzyvant与杜克大学签订了开发RVT-802的独家全球许可协议。RVT-802曾被FDA授予突破性疗法认定,再生医学先进疗法(RMAT)认定,罕见儿科疾病认定和孤儿药资格。
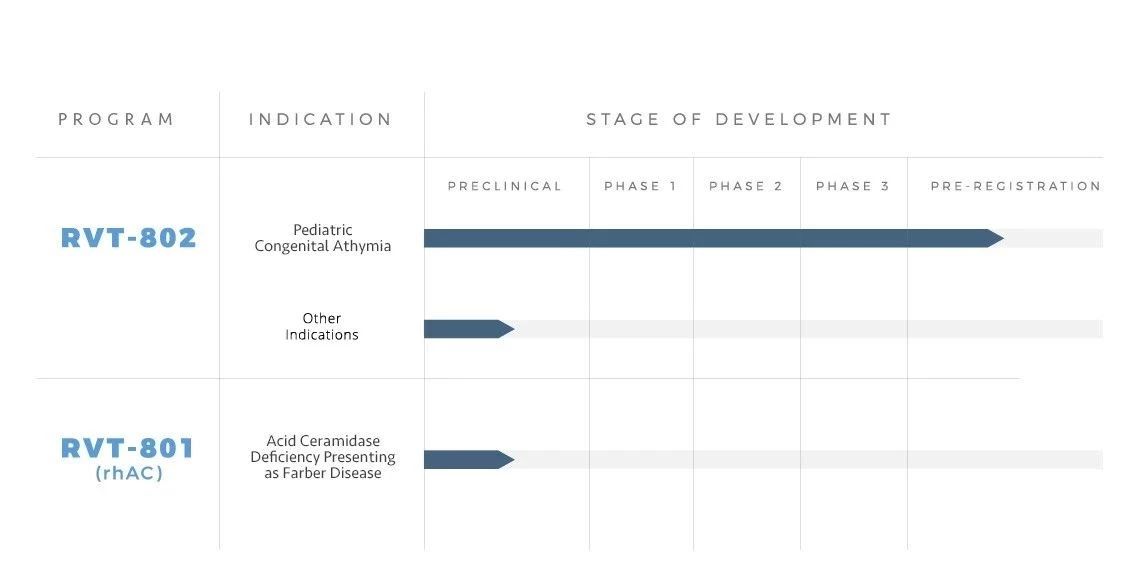
▲Enzyvant的研发管线(图片来源:Enzyvant官方网站)
RVT-802的BLA申请基于证明其长期有效性的临床试验数据。共有93名患儿接受了RVT-802,其中85名患儿符合纳入功效分析的标准。接受治疗后的第一年和第二年的Kaplan-Meier估计生存率分别为76%(66%-84%)和75%(66%-83%)。对于在治疗后存活超过12个月的患儿,他们的10年预计存活率为93%。
Enzyvant首席执行官Rachelle Jacques先生说:“Enzyvant很自豪能推进RVT-802这一大胆,革命性的再生疗法。挽救先天性无胸腺症婴幼患儿生命的紧迫感,让我们与杜克大学建立了合作伙伴关系,并继续激励我们以专注的态度快速地迈向未来的获批。RVT-802作为一次性疗法的长期数据,强化了其潜在挽救和持续保护生命的价值。”
参考资料:
[1] Enzyvant Announces FDA Acceptance of Biologics License Application (BLA) and Priority Review Status for RVT-802, a Novel Investigational Tissue-Based Regenerative Therapy for Pediatric Congenital Athymia. Retrieved June,5, 2019, from https://www.biospace.com/article/releases/enzyvant-announces-fda-acceptance-of-biologics-license-application-bla-and-priority-review-status-for-rvt-802-a-novel-investigational-tissue-based-regenerative-therapy-for-pediatric-congenital-athymia/
[2] 速递 | 儿童遗传病创新疗法获FDA突破性疗法认定. Retrieved June,5, 2019, from https://mp.weixin.qq.com/s/duiO_UZzd9wKt05Sq5-YbQ
[3] 速递 | 罕见病突破性疗法递交滚动上市申请,有望年底完成. Retrieved June,5, 2019, from https://mp.weixin.qq.com/s/qIebJYFc_GJh73WUz4GWIA
- 王老吉药业携手安徽国胜大药在合肥开展“关
8月6日,广州王老吉药业华东区安徽区域联合国胜大药房举行“关...
- 携手怡康医药 王老吉为“烈日下最可爱的人
连日来,高温酷暑,热浪滚滚,骄阳似火。但在西安街头,始终有一...
- 大参林携手王老吉举办“读懂心里画 让爱不
初夏也是传染病高发季,2024年6 月2日王老吉药业湖北办团...
- 读懂心里“画“让爱不上火
——王老吉药业携手伟锋连锁举办六一亲子活动2024年...



