重磅!全国辅助用药目录将出台
整理:焦萌萌
12月13日,国家卫健委印发《关于做好辅助用药临床应用管理有关工作的通知》(下称《通知),明确要制订全国辅助用药目录。
全国辅助用药目录将出台
《通知》指出,制订全国辅助用药目录。各省级卫生健康行政部门组织辖区内二级以上医疗机构,将本机构辅助用药以通用名并按照年度使用金额(2017年12月1日至2018年11月30日)由多到少排序,形成辅助用药目录,并上报省级卫生健康行政部门。每个医疗机构辅助用药品种原则上不少于20个。由各省级卫生健康行政部门汇总后,将前20个品种信息上报国家卫生健康委。国家卫生健康委制订全国辅助用药目录并公布。
《通知》要求,在全国辅助用药目录基础上,制订省级和各医疗机构辅助用药目录。
国家卫健委将定期对全国辅助用药目录进行调整,调整时间间隔原则上不短于1年。
《通知》明确规定,将对辅助用药管理目录中的全部药品进行重点监控。严格落实处方审核和处方点评制度,将辅助用药全部纳入审核和点评范畴,充分发挥药师在辅助用药管理和临床用药指导方面的作用。
同时,各级卫生健康行政部门和各级各类医疗机构要建立完善辅助用药监测评价和超常预警制度,将辅助用药临床应用情况作为医疗机构绩效考核工作的重要内容,充分运用考核结果,促进提升辅助用药科学管理水平。
辅助用药市场萎缩成大势
在医保控费高歌猛进的时候,一批辅助用药成为众矢之的,无论是医保目录调整层面限制,还是控制药占比层面,这类品种都是首当其冲。
近两年来,“辅助用药”虽没有明确定义,但江苏、福建、河南多省市陆续出台辅助用药名录,明确限制使用辅助药。例如适当加大辅助用药的个人自付比例,拉开与其他乙类药品的支付比例档次,设置医保结算价为只有其医保最高销售价的50%等。
中国医药工业信息中心PDB数据库显示,2018Q3前50大品种中,单唾液酸四己糖神经节苷脂、磷酸肌酸、鼠神经生长因子等临床效果不明显,药物经济学差的品种较Q2继续下滑。
表1 部分受监控品种销售增长情况
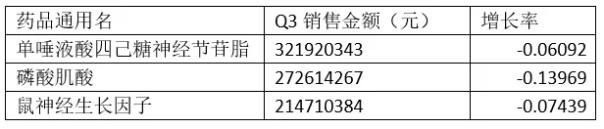
数据来源:中国医药工业信息中心PDB数据库
从不久前发布的新版《国家基本药物目录》调出的药物也可以发现,曾发生严重不良反应、经评估不宜再作为基本药物的品种,耗资巨大又没有明确疗效的所谓神药、辅助用药是调出重点。
未来,医药行业结构性分化将是长期趋势,辅助用药和安全性、有效性存疑的大品种将进一步承压,而临床效果明确的治疗性产品、满足临床实际需求的创新产品、质量疗效安全可控的进口替代产品和物美价廉的低价药产品将获得市场发展良机。
附:
关于做好辅助用药临床应用管理有关工作的通知
各省、自治区、直辖市及新疆生产建设兵团卫生健康委(卫生计生委):
为加强医疗机构辅助用药临床应用管理,规范辅助用药临床应用行为,提高合理用药水平,维护人民群众健康权益,现就做好辅助用药临床应用管理有关工作提出以下要求:
一、提高认识,高度重视辅助用药临床应用管理工作
加强辅助用药临床应用管理,是落实深化医药卫生体制改革任务、控制公立医院医疗费用不合理增长的明确要求,也是减轻患者看病就医负担、维护人民健康权益的重要举措。各级卫生健康行政部门和各级各类医疗机构必须高度重视辅助用药临床应用管理工作,本着对人民健康高度负责和科学合理的原则,加强辅助用药临床应用管理,努力实现安全有效经济的合理用药目标。
二、明确责任,建立辅助用药临床应用管理制度
医疗机构是辅助用药临床应用管理的责任主体,医疗机构主要负责人是辅助用药临床应用管理第一责任人。要将辅助用药管理作为医疗机构药事管理的重要内容,进行统筹管理。要建立健全管理制度和工作机制,加强辅助用药遴选、采购、处方、调剂、临床应用、监测、评价等各环节的全程管理。医疗机构在调整完善药品处方集和基本用药供应目录时,如需纳入辅助用药,应当由药事管理与药物治疗学委员会,依据药品说明书和用药指南等,充分评估论证辅助用药的临床价值,按照既能满足临床基本需求又适度从紧的原则,进行严格遴选。
三、制订目录,明确医疗机构辅助用药范围
(一)制订全国辅助用药目录。各省级卫生健康行政部门组织辖区内二级以上医疗机构,将本机构辅助用药以通用名并按照年度使用金额(2017年12月1日至2018年11月30日)由多到少排序,形成辅助用药目录,并上报省级卫生健康行政部门。每个医疗机构辅助用药品种原则上不少于20个。各省级卫生健康行政部门汇总辖区内医疗机构上报的辅助用药目录,以通用名并按照使用总金额由多到少排序,将前20个品种信息上报国家卫生健康委(报送表格见附件)。国家卫生健康委制订全国辅助用药目录并公布。
(二)制订省级和各医疗机构辅助用药目录。各省级卫生健康行政部门在国家公布的辅助用药目录基础上,制订本省份辅助用药目录,省级辅助用药目录不得少于国家辅助用药目录。二级以上医疗机构在省级辅助用药目录基础上,增加本机构上报的辅助用药品种,形成本机构辅助用药目录。其他医疗机构根据实际情况,在省级辅助用药目录的基础上,制订本机构辅助用药目录。
(三)制订辅助用药目录的原则和时限要求。各级卫生健康行政部门和各级各类医疗机构在制订辅助用药目录的过程中,应当遵循“公开、公平、公正、透明”的原则,将辅助用药目录纳入政务公开和院务公开管理,在官方网站或以适当形式进行公布。各省级卫生健康行政部门应当于2018年12月31日前,将汇总的辅助用药目录报送我委,并在我委公布全国辅助用药目录后10个工作日内,公布省级辅助用药目录。我委将定期对全国辅助用药目录进行调整,调整时间间隔原则上不短于1年。
四、规范行为,持续提高临床合理用药水平
各级各类医疗机构要根据临床诊疗实际需求,制订本机构辅助用药临床应用技术规范,明确限定辅助用药临床应用的条件和原则,要求医师严格掌握用药指征,严格按照药品说明书使用,不得随意扩大用药适应证、改变用药疗程、剂量等。进一步加强临床路径管理,科学设计临床路径,规范临床诊疗行为。对辅助用药管理目录中的全部药品进行重点监控。严格落实处方审核和处方点评制度,将辅助用药全部纳入审核和点评范畴,充分发挥药师在辅助用药管理和临床用药指导方面的作用。
五、加强监测考核,推进辅助用药科学管理
各级卫生健康行政部门和各级各类医疗机构要建立完善辅助用药监测评价和超常预警制度,依托相关信息平台,对辅助用药临床使用情况进行分析、评估,定期通报监测结果及相关预警信息。医疗机构要根据处方审核和处方点评结果、药品使用量、使用金额等,科学设定辅助用药临床应用考核指标,定期对本机构辅助用药合理应用情况进行考核,考核结果及时公示。各级卫生健康行政部门要将辅助用药临床应用情况作为医疗机构绩效考核工作的重要内容,充分运用考核结果,促进提升辅助用药科学管理水平。
- 王老吉药业携手安徽国胜大药在合肥开展“关
8月6日,广州王老吉药业华东区安徽区域联合国胜大药房举行“关...
- 携手怡康医药 王老吉为“烈日下最可爱的人
连日来,高温酷暑,热浪滚滚,骄阳似火。但在西安街头,始终有一...
- 大参林携手王老吉举办“读懂心里画 让爱不
初夏也是传染病高发季,2024年6 月2日王老吉药业湖北办团...
- 读懂心里“画“让爱不上火
——王老吉药业携手伟锋连锁举办六一亲子活动2024年...



